Grandezze fondamentali
Il sistema di misura SI
A livello internazionale è stato raggiunto un accordo sull'uso, nel futuro, del
"sistema SI" (Systeme International d'Unitès) in sostituzione del sistema
metrico.
| Grandezza |
Sistema metrico |
Sistema SI |
| Temperatura |
°C |
°K °C |
| Forza |
kg forza |
N (Newton) |
| Pressione |
at-ata ato mm Hg |
Pa (Pascal) bar |
| Lavoro, |
energia kgfm, |
kcal J (Joule) |
| Potenza |
hp, |
kcal/h Watt |
| Enthalpia |
kcal/kg |
J/kg |
Occorrerà parecchio tempo prima che questo sistema di misura sia generalmente
adottato nel campo frigorifero, ma poiché vari paesi industrializzati hanno
progettato le specifiche e la legislazione relativa, è necessario per tutti
abituarsi giorno per giorno all'uso del sistema SI.
Pressione:
Quando una forza agisce su una superficie I'effetto prodotto dipende
dall'estensione della superficie stessa. Come esempio evidente si consideri uno
sciatore che grazie agli sci, può rimanere sulla neve senza sprofondare. In
effetti gli sci distribuiscono il peso della persona su una grande superficie in
modo che il suo peso, riferito all'unità di superficie della neve, è
relativamente piccolo

La pressione è definita come il rapporto fra la forza agente a la superficie
sulla quale agisce. Essa può essere misurata con diverse unità di misura in
funzione delle finalità della misura stessa.
Fra queste il kgf/cm è la più comune nel sistema metrico.L'unità è spesso
indicata con "at" ed equivale ad una atmosfera tecnica. In condizioni normali la
pressione dell'aria è di 1,033 kgf/cm, equivalente ad una atmosfera fisica.
L'abbreviazione è, in tale caso, "atm".
Si possono avere diverse definizioni della pressione in funzione di come si
sceglie il punto di vuoto uguale a zero. Se si assume come valore "zero" il
vuoto assoluto la designazione usata è "ata" dove la lettera "a" finale
significa "assoluta". Questa unità di misura è più frequentemente usata net
campo frigorifero anche se sui manometri si può trovare "ato". "Ata" sta per
"sovrapressione" in riferimento all'atmosfera fisica. Di conseguenza il punto
"zero" corrisponde ad 1 atm od a 1,033 ata.
Un'altra unità di misura della pressione, che si incontra di frequente, è il mm
di colonna di mercurio, abbreviata in "mm Hg". La pressione dell'aria
corrisponde a 760 mm Hg, che di conseguenza corrisponde a 1 atm o a 1,033 ata.
Infine, in riferimento alle pompe di circolazione dell'acqua, si trova spesso
l'unità "metro di colonna di acqua". L'abbreviazione è "m.c.a." e 10 m c.a.
corrispondono a 1 ata e10,33 m c.a. corrispondono a 1 atm. L'unità di misura
della pressione nel sistema SI è il Newton/m, chiamato anche Pascal "Pa". Poiché
questa unità assume valori motto piccoli, nel campo frigorifero si usa invece
I'unità di misura "bar" dove 1 bar = 10 Pa. Fortunatamente 1 at = 0,9807 bar ?1
bar.
Questo è il motivo per cui in pratica è spesso possibile usare lo stesso valore
in entrambi i sistemi di misura sia che si sia adottato il sistema SI che il
sistema metrico. < BR >
Calore
II calore è una forma di energia invisibile. Solamente i suoi effetti sono
evidenziati e la misura di tali effetti viene usata per dare la definizione di
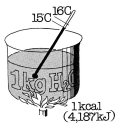
"Calore". L'unità di misura del calore, nel sistema metrico è la caloria "cal"
che corrisponde alla quantità di calore necessaria ad innalzare la temperatura
di 1 g (grammo) di acqua da 15°C a 16°C. Nel campo frigorifero è normale usare
la "kcal" che equivale a 1.000 cal.. Nel sistema SI l'unità di misura per tutte
le forme di lavoro, compreso il calore, è il Joule "J". Per convertire dal
sistema metrico al sistema SI: · 1 cal = 4,187 J · 1 kcal = 4,187 kJ
Grande è la differenza fra le quantità di calorie necessarie per innalzare di 1
°C varie sostanze; 1 kg di ferro richiede 0,114 Kcal mentre 1 kg di aria
necessita di 0,24 kcal. II "calore specifico" di una sostanza è la quantità di
calore necessaria per aumentare di 1 °C la temperatura di 1 kg della sostanza
stessa. I calori specifici delle varie sostanze possono essere trovati in
tabelle e sono misurati in kcal/kg°C nel sistema metrico ed in kJ/kg°C nel
sistema SI.
Cambiamenti di stato delle sostanze
Qualunque sostanza può esistere in tre differenti stati di aggregazione: solido,
liquido e gassoso. L'acqua è l'esempio più naturale: la sua forma solida è il
ghiaccio, essa ci circonda allo stato liquido mentre allo stato gassoso è il
vapore. Comune a questi tre stati di aggregazione è la molecola che rimane
invariata; acqua, ghiaccio a vapore hanno la stessa molecola, il cui simbolo
chimico è H2O.
La temperatura e la pressione sono le grandezze di una sostanza necessarie per
stabilire se essa si trova allo stato solido, liquido o gassoso. La temperatura
alla quale una sostanza passa dallo stato solido allo stato liquido si chiama
"temperatura di fusione". Durante la fusione la temperatura rimane costante;
tutto il calore che viene fornito serve al passaggio dallo stato solido allo
stato liquido. Solamente quando tutta la sostanza è completamente fusa il calore
che viene ulteriormente fornito permette alla temperatura di aumentare
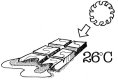
nuovamente. Differenti sostanze hanno differenti temperature di fusione (punto
di fusione). Ad esempio il cioccolato fonde a 26°C. Come esempio si può
osservare ciò che avviene dentro una piccola ghiacciaia.
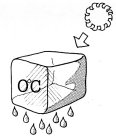
Introdotto il ghiaccio a ? 10°C esso si riscalda in un primo tempo sino alla
temperatura di 0°C perchè assorbe calore dall'ambiente circostante e dai
prodotti conservati nella ghiacciaia. Quindi, continuando ad assorbire calore,
il ghiaccio comincia a sciogliersi (a fondere) e durante tutto il processo di
fusione la temperatura rimane costante a 0°C. Se non si aggiunge altro ghiaccio
lo scioglimento è completo e l'acqua formatasi si raccoglie nella vaschetta di
fondo della ghiacciaia. Da quel momento la temperatura interna della ghiacciaia
comincia ad aumentare tendendo a raggiungere il valore della temperatura
ambiente.
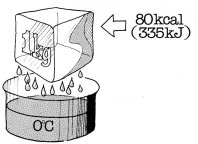
La quantità di calore che deve essere ceduta ad una sostanza perchè avvenga la
fusione si chiama "calore di fusione". Esso è definito come la quantità di
calore necessaria per fare fondere 1 kg della sostanza stessa, preventivamente
riscaldata sino alla temperatura del punto di fusione. Prendendo ad esempio
I'acqua il calore di fusione del ghiaccio è di 80 kcal/kg (335 kJ/kg). La
conoscenza dei processi che avvengono durante i cambiamenti di stato delle
sostanze è importante per quanto riguarda la refrigerazione perchè:
· i cambiamenti di stato avvengono a temperatura costante
· i cambiamenti di stato richiedono una quantità di calore relativamente grande
per ogni kg di sostanza.
Calore di evaporazione
Poiché le caratteristiche dell'acqua sono di facile osservazione e poiché
l'acqua si comporta come la maggior parte dei fluidi frigorigeni essa viene
presa ad esempio in questo paragrafo.
Quando I'acqua viene riscaldata la sua temperatura si innalza finchè incomincia
a bollire; la temperatura di ebollizione ("punto dì ebollizione") dipende dalla
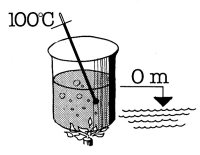
pressione alla quale si trova I'acqua. In un recipiente aperto ed alla normale
pressione atmosferica a livello del mare, 760 mm Hg, I'acqua bolle a 100°C.
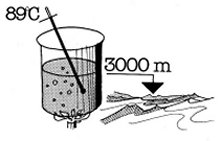
Se la pressione scende al disotto di quella atmosferica il punto di ebollizione
è inferiore a 100 °C. Per esempio, ad una pressione di 531 mm Hg (equivalenti ad
una altezza di 3.000 m al disopra del livello del mare) il punto di ebollizione
è di 89 °C.
In un recipiente chiuso il punto di ebollizione è determinato dalla pressione
del vapore. Se la pressione è superiore a 760 mm Hg il punto di ebollizione
supera i 100°C. Per esempio, il punto di ebollizione dell'acqua è di 120°C
quando la pressione è 1 at superiore a quella atmosferica e di 183°C quando la
pressione supera di 10 at quella atmosferica. Questo principio è sfruttato nella
pentola a pressione.
L'acqua al punto di ebollizione è anche chiamata liquido saturo e, di
conseguenza, la temperatura di ebollizione è pure nota come "temperatura di
saturazione". Ad ogni data pressione corrisponde una temperatura di ebollizione
o temperatura di saturazione ed i valori per I'acqua sono riportati nella
tabella seguente.
| Pressione |
Temperatura |
Pressione |
Temperatura |
| ata |
°C |
bar |
°C |
| 0,2 |
60 |
2,0 |
120 |
| 0,4 |
75 |
4,0 |
143 |
| 0,6 |
86 |
6,0 |
158 |
| 0,8 |
93 |
8,0 |
170 |
| 1,0 |
99 |
10,0 |
179 |
La quantità di energia (calore) da fornire ad un liquido per farlo evaporare è
chiamato "calore di evaporazione". La quantità di calore necessaria, alla
pressione atmosferica (760 mm Hg), per fare evaporare 1 Kg. di acqua a 100°C è
di 539 kcal (2,260kj). Nel caso dell'acqua si forma 1 kg di "vapore saturo". Se
viene fornita una quantità di calore inferiore al calore di evaporazione,
solamente una parte del liquido si trasforma in vapore e si ottiene una miscela
di liquido saturo e di vapore saturo.
II calore di evaporazione è pure chiamato "calore latente". Esso è la quantità
di calore che può essere fornito ad una sostanza senza causarne una variazione
di temperatura. Per contro si chiama "calore sensibile" la quantità di calore da
fornire o da sottrarre ad una sostanza che si trova ad una temperatura inferiore
o superiore al punto di ebollizione o di fusione, per farne variare la
temperatura.
Calore di surriscaldamento
Quando si fornisce calore ad un vapore saturo si ottiene del vapore
surriscaldato, il calore fornito si chiama "calore di surriscaldamento". Poiché
è già avvenuto un cambiamento di stato (I'evaporazione) entra in gioco il calore
sensibile che causa l'aumento di temperatura del vapore. II calore specifico di
una sostanza ha valori diversi se la sostanza si trova alto stato solido o
liquido o di vapore. Per esempio per riscaldare di 1 °C 1 kg di vapore sono
necessarie 0,45 kcal (1 ,9 kj), mentre per lo stesso aumento di temperatura
dell'acqua occorre 1 kcal (4,187 kJ).
Il processo di condensazione
II cambiamento di stato inverso al passaggio da liquido a vapore è il passaggio
da vapore a liquido. Questo processo è chiamato "condensazione". Invece di
fornire una certa quantità di calore è necessario sottrarre la stessa quantità
per trasformare il vapore in liquido.
Anche in questo caso la pressione determina la
temperature alla quale avviene la condensazione. Il diagramma temperatura -
entalpia
Le caratteristiche di una sostanza possono essere rappresentate in un diagramma
temperatura entalpia nel quale i valori dell'entalpia sono riportati sull'asse
delle ascisse mentre i valori della temperatura sono riportati sull'asse delle
ordinate.
L'entalpia è spesso chiamata anche "calore totale" o "contenuto di calore" e
rappresentala totalità dell'energia posseduta da una sostanza. Nel diagramma
sotto riportato, si è presa come esempio I'acqua a pressione atmosferica.
La curva del diagramma inizia dal punto A con la temperatura dell'acqua = 0°C ed
entalpia = 0 kcal/kg. Fornendo calore sensibile si produce il riscaldamento dal
punto A al punto B corrispondente alla temperatura di ebollizione dell'acqua. La
differenza di temperatura fra A e B corrisponde ad un aumento di 100 °C. Come
detto in precedenza ogni °C di aumento di temperatura di 1 Kg. di acqua richiede
1 kcal (4,187 kJ), quindi la quantità totale di calore da fornire per passare da
A (0°C) a B (100°C) e di 100 kcal (4,187 kJ)per ogni Kg. Di conseguenza il
valore dell'entalpia (Calore totale) del punto B e di 10Q kcal/kg (418,7 kJ/kg).
II tratto B?C corrisponde al calore latente (Calore di evaporazione) necessario
per trasformare 1 kg di acqua allo stato liquido (punto B) in vapore saturo
(punto C). II calore di evaporazione di 1 kg di acqua alla pressione atmosferica
è, come già noto, di 539 kcal/kg (2.260 kJ/kg) e di conseguenza il valore dell'entalpia
nel punto C è la somma del calore totale fornito = 100 + 539 = 639 kcal/kg
(2.678,7 kJ/kg).
É importante notare che nel passaggio dal punto B al punto C non si producono
variazioni di temperatura.II tratto C ? D rappresenta l'effetto del calore
sensibile sul vapore e cioè il surriscaldamento. II calore specifico del vapore
è, come detto in precedenza di 0,45 kcal/kg°C (1,88 kJ/kg). Nell'esempio del
diagramma l'aumento di temperatura da C a D è di 120?100=20 °C a la quantità di
calore necessaria per produrre tale aumento è di 20 x 0,45 = 9 kcal/kg
(20x1,88=37,6 kJ/kg). L'entalpia nel punto D è la somma del calore totale
fornito e cioè 939 + 9 = 648 kcal/kg (2.678,7+37,6=2.716,3 kJ/kg).
Il diagramma pressione - entalpia
Come precedentemente accennato la relazione temperatura?entalpia dipende dalla
pressione ed al paragrafo 2.8 si è illustrato un diagramma prendendo I'acqua
come esempio. Per dare quindi le caratteristiche temperatura?entalpia di una
sostanza occorrerebbe un diagramma per ogni valore della pressione. Poiché la
cosa è poco pratica al posto del diagramma suddetto si usa il diagramma
pressione entalpia. Tale diagramma è rappresentato qui sotto. Si riportano
sull'asse delle ordinate le pressioni con i valori in scala logaritmica. L'entalpia
è sempre riportata sull'asse delle ascisse in scala aritmetica.
Poichè nei calcoli frigoriferi è necessario lavorare con diverse pressioni e
temperature,
questo diagramma offre una via pratica per determinare graficamente le
variazioni di energia
in un impianto.








